Зарегистрируйтесь, чтобы делать покупки, отслеживать заказы и пользоваться персональными скидками и баллами.
Зарегистрируйтесь, чтобы делать покупки, отслеживать заказы и пользоваться персональными скидками и баллами.

Азотная кислота является одной из самых узнаваемых кислот. Это вещество имеет широкий спектр применения, интересные химические свойства и, самое главное, обладает высокой коррозионной активностью. Рассказываем, как производится это вещество и какие опасности могут быть связаны с его использованием.Читать далее →
Азотная кислота является одной из самых узнаваемых кислот. Это вещество имеет широкий спектр применения, интересные химические свойства и, самое главное, обладает высокой коррозионной активностью. Рассказываем, как производится это вещество и какие опасности могут быть связаны с его использованием.
Определение
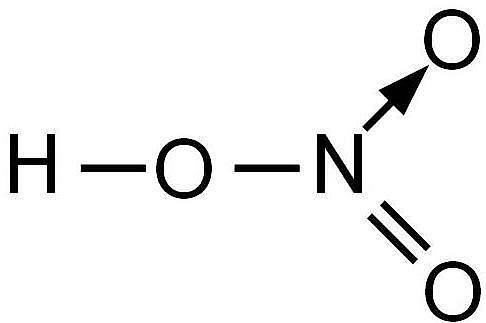
Азотная кислота (лат. acidum nitricum) с химической формулой HNO3 — неорганическое химическое соединение, относящееся к сильнейшим известным оксикислотам. Имеет кислотный остаток в виде нитратной группы, содержащей азот в пятой степени окисления. В концентрированном виде обладает сильным коррозионным действием.
В коммерческом применении азотная кислота применяется в виде водного раствора (также отсутствует дымящий эффект, возникающий при концентрации выше 86%).
Химические и физические свойства азотной кислоты
Чистая азотная кислота представляет собой бесцветную жидкость, хорошо растворимую в воде. Имеет резкий и удушающий запах. На открытом воздухе можно заметить легкий коричневый дым, вызванный оксидом азота (IV), который очень ядовит. Поэтому даже кратковременное вдыхание паров азотной кислоты может вызвать раздражение органов дыхания, слезотечение или кашель. Азотная кислота при длительном хранении подвергается частичному разложению и приобретает желтую или коричневую окраску. Такое окрашивание происходит из-за разложения азотной кислоты на оксиды азота и воды. Этот процесс протекает быстрее при наличии света и повышенной температуры.
Концентрированный раствор азотной кислоты химически очень активен. С некоторыми веществами он может реагировать очень бурно. Благодаря вышеперечисленным свойствам он может воспламенять легковоспламеняющиеся материалы. При растворении в воде выделяется большое количество тепла (экзотермическая реакция).
Как сама азотная кислота, так и ее соли обладают сильным окислительным действием. Это заставляет его бурно реагировать с металлами, не вытесняющими водород (медь, серебро). Эта кислота способна растворять даже некоторые неметаллы. Алюминий, хром и железо пассивируются при контакте с концентрированной азотной кислотой.
|
Формула азотной кислоты |
HNO3 |
|
Молярная масса |
63,01 г/моль |
|
Вид |
Прозрачная бесцветная жидкость |
|
Плотность |
1,5129 г/см³ (20 °C) |
|
Кислотность |
−1,4 пК а |
|
Точка кипения |
83 °С |
|
Температура плавления |
−41,6 ° С |
|
Давление газа |
48 мм рт.ст. (20°C) |
Производство
Техническая азотная кислота концентрацией от 52 до 68% производится по методу Оствальда. Вкратце, он заключается в каталитическом окислении аммиака на платиновой или платинородиевой сетке (требуется высокая температура 227°С и высокое давление до 9 атм.). В свою очередь, сам аммиак для целей этого процесса получают путем прямого синтеза водорода и азота (реакция Габера и Боша). Первым образуется оксид азота (II), который окисляется до оксида азота (IV) в присутствии воздуха. Затем полученный таким образом оксид азота подвергают диспропорционированию в воде, в результате чего получают азотную кислоту и азотистую кислоту. Из-за того, что азотистая кислота не обладает высокой стабильностью, происходит ее дальнейшее диспропорционирование.
Водный раствор азотной кислоты окончательно получают перегонкой всего отвара до уровня 68%. Его концентрат можно получить обезвоживанием концентрированной серной кислотой.
Применение

Азотная кислота является важным промежуточным звеном в производстве удобрений и других химических соединений, например, фосфорной кислоты, щавелевой кислоты, коллодия, аминов, красителей или лекарств. Это также сырье для производства взрывчатых веществ, таких как нитроглицерин.
Азотная кислота также используется в:
- производство нитратов, сложных эфиров и нитросоединений (таких как тротил);
- обнаружение белков в ксантопротеиновой реакции (аналитическая химия);
- очистка металлических поверхностей;
- быстрое травление печатных плат;
- производство красителей, лаков, удобрений и пластмасс;
- окисление топлива - в том числе гиперголических ракетных топлив, которые самовозгораются в результате смешения компонентов.
Цены на азотную кислоту обычно колеблются в районе 600 рублей за 1 литр 55-65% водного раствора. Купить азотную кислоту можно в нашем интернет-магазине.
Опасность для здоровья
Как азотная кислота в жидком виде, так и ее пары очень вредны для организма человека. Вдыхание азотной кислоты приводит к отеку и пневмонии. Пролитая на кожу, она вызывает трудно поддающиеся лечению ожоги, которые обычно заканчиваются некрозом. Более обширные ожоги азотной кислотой могут даже привести к коллапсу или шоку и могут представлять серьезную опасность для жизни. Наибольшую опасность вызывает попадание в организм азотной кислоты, что нередко приводит к смерти человека (прожигаются стенки желудка и кишечника).
Хранение
Из-за своих высококоррозийных свойств азотную кислоту следует хранить в соответствующей таре (кислотостойкой) и хранить в хорошо проветриваемых помещениях без доступа света. Следует строго избегать хранения азотной кислоты вблизи легковоспламеняющихся или взрывоопасных материалов.
