Зарегистрируйтесь, чтобы делать покупки, отслеживать заказы и пользоваться персональными скидками и баллами.
Зарегистрируйтесь, чтобы делать покупки, отслеживать заказы и пользоваться персональными скидками и баллами.

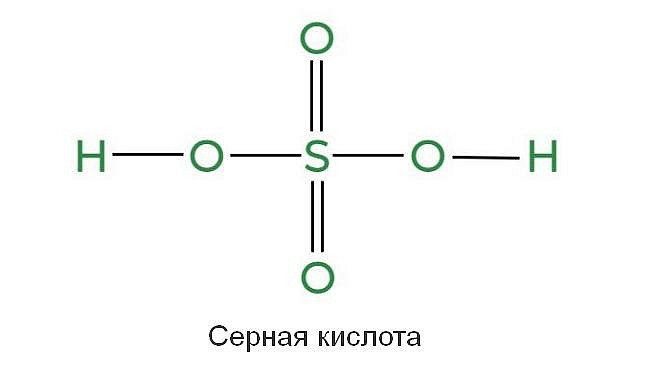
Серная кислота (VI) (H₂SO₄) — неорганическое химическое соединение, относящееся к группе кислородных кислот, построенное из центрально расположенного атома серы (S), соединенного одинарными ковалентными связями с двумя гидроксильными группами (ОН) и двойными ковалентными связями.
Серная кислота (VI) (H₂SO₄) — неорганическое химическое соединение, относящееся к группе кислородных кислот, построенное из центрально расположенного атома серы (S), соединенного одинарными ковалентными связями с двумя гидроксильными группами (ОН) и двойными ковалентными связями. с двумя атомами кислорода (О). Проще говоря, серная кислота имеет два атома водорода, один атом серы и четыре атома кислорода.
Это интересно. До 19 века серная кислота также имела тривиальное название купоросное масло (производное от купороса), которое сегодня больше не используется.
Свойства серной кислоты
|
Молярная масса |
98,079 г/моль |
|
Плотность (при стандартных условиях) |
1,84 г/ см3 |
|
Растворимость |
хорошо растворяется в воде |
|
Значение рКа |
-3 |
|
Значение pH |
2,75 |
|
Точка кипения |
+337 °С |
|
Температура плавления |
+10,31 °С |
|
Особенности |
|
Концентрированная и разбавленная серная кислота
Очень высокая концентрация называется концентрированной серной кислотой, т.е. не менее 98,3% или количество вещества 17,966 моль/л. Обычно он имеет плотность 1,836 г/см 3.
Разбавленная серная кислота с концентрацией около 10% или количеством вещества 1,087 моль/л имеет меньшую плотность, чем концентрированная кислота, а именно всего около 1,066 г/см 3.
Серная кислота представляет собой бесцветную маслянистую жидкость без запаха с плотностью 1,84 г/см³ (20°С). Обладает сильными гигроскопическими свойствами; проявляет способность поглощать водяные пары, содержащиеся в атмосферном воздухе. При нагревании выше 300°C серная кислота начинает постепенно разлагаться на воду (H₂O) и удушающие пары триоксида серы (SO₃). Хорошо растворяется в воде и других полярных растворителях; разбавление водой протекает с выделением большого количества теплоты (экзотермический процесс). Серная кислота — одна из сильнейших неорганических кислот, проявляющая высокую химическую активность. В водных растворах почти полностью диссоциирует с образованием ионов гидроксония (H₃O⁺) и кислых гидросульфатов (HSO₄⁻) и нейтральных сульфатов (SO₄²⁻). Разбавленная серная кислота растворяет большинство металлов (кроме драгоценных металлов). Концентрированная серная кислота при повышенной температуре окисляет большинство металлов (включая благородные металлы) и неметаллы (например, углерод, серу); является сильным дегидратирующим агентом, обугливающим органические вещества (например, углеводы). Серная кислота, получаемая в промышленных масштабах контактным способом, применяется в химической, фармацевтической, текстильной, бумажной, кожевенной и металлургической промышленности; разбавленная серная кислота (аккумуляторная кислота) действует как электролит в свинцовых батареях.
Производство серный кислоты
Сегодня серную кислоту в основном производят так называемым контактным способом. Метод работает в три этапа. Однако, прежде чем это может произойти, элементарная сера должна еще прореагировать с кислородом с образованием диоксида серы (SO 2):
S + O2 → SO2
Шаг 1: Триоксид серы (SO 3) образуется из диоксида серы и кислорода:
2 SO2 + O2 → 2 SO3
Шаг 2: Триоксид серы плохо растворим в воде. Однако для получения серной кислоты необходим оксид. Поэтому SO 3 необходимо предварительно растворить в концентрированной серной кислоте. Это создает дисерную кислоту (H₂S₂O₇):
SO 3 + H 2 SO 4 → H 2 S 2 O 7
Шаг 3: Если вы позволите серной кислоте вступить в реакцию с водой, вы, наконец, получите серную кислоту:
H2S2O7 + H2O → 2H2SO4 _ _ _ _ _ _ _
В интернет-магазине Химбаза вы можете купить серную кислоту по цене от 450 руб. за литр.
Серная кислота в природе
Свободная серная кислота, не диссоциированная на оксониевые соединения и сульфат-ионы, в природе встречается очень редко. В атмосфере образуется из диоксида серы, который образуется при сжигании серосодержащих веществ или при извержении вулканов. Диоксид серы окисляется до триоксида серы гидроксильными радикалами и кислородом. Наконец, с водой образуется свободная серная кислота. Другими окислителями, которые способствуют образованию триоксида серы, являются озон или перекись водорода. Под кислотным дождем затем он достигает земли в виде разбавленной кислоты (в основном в виде гидросульфата и сульфата).
Небольшое количество свободной серной кислоты также содержится в некоторых вулканических источниках, называемых сольфатарами.
В отличие от свободной кислоты ее соли, особенно сульфаты, встречаются в природе гораздо чаще. Существует множество различных сульфатных минералов. Наиболее известны и наиболее важны гипс (CaSO4.2H2O), барит (BaSO₄), халькантит (CuSO4∙5H2O) или глауберова соль (Na2SO4 · 10H2O).
Серная кислота, образующаяся в воздухе из двуокиси серы, является компонентом кислотных дождей наряду с азотной кислотой, образующейся из окислов азота. Кислотные дожди могут привести к снижению значения pH.

За пределами Земли серная кислота содержится в верхних слоях атмосферы Венеры. Это создается фотохимическими реакциями между диоксидом серы и водой. Образуются капли, содержащие 80-85% серной кислоты. В более глубоких слоях из-за высоких температур кислота разлагается на сернистый газ, кислород и воду, которые могут снова подняться и образовать серную кислоту.
Серная кислота опасность и меры предосторожности

Серная кислота очень едкая, окисляющая и обезвоживающая, поэтому при попадании на ткани может сильно повредить их. Даже незначительное количество серной кислоты при контакте с кожей может вызвать сильные химические ожоги. Контакт с глазами может привести к необратимым повреждениям зрения и слепоте.
Следует также соблюдать осторожность при вдыхании газа, выделяющегося при реакциях серной кислоты с другими веществами, так как он вызывает одышку и жжение в дыхательной системе.
Серная кислота сама по себе не представляет опасности возгорания или взрыва, но следует учитывать, что она может быть горючей в сочетании с другими материалами, даже с водой. Одной из мер предосторожности при обращении с серной кислотой заключается в том, что ее всегда нужно добавлять в воду, а не наоборот. Поскольку при разбавлении серной кислоты выделяется много тепла, добавление воды к серной кислоте может вызвать экзотермическую реакцию, вызывающую возгорание или брызги кислоты.
По этой причине при контакте кожи с серной кислотой ее нельзя сразу же промывать водой, как это происходит с большинством кислот. Вместо этого первым делом нужно нейтрализовать серную кислоту мыльной или известковой водой. После этого любые следы едкого вещества будут удалены путем обильного стекания воды по коже. Кроме того, необходимо снять одежду, украшения или любой другой предмет, который контактировал с кислотой. Важно делать это до тех пор, пока химический агент присутствует, он будет продолжать повреждать ткани.
